Trong Oxy hóa nâng cao thì quá trình Fenton và các quá trình kiểu Fenton (Fenton- like processes) được biết đến là phương pháp hiệu quả và không đắt cho quá trình làm sạch nước và nước thải. Phương pháp Fenton cổ điển là công trình nghiên cứu của J.H. Fenton được công bố vào năm 1894 trong tạp chí hội hóa học Mỹ
I. Quá trình Fenton:
Quá trình Fenton cổ điển nói chung có hiệu quả cao trong khoảng pH 2-4, cao nhất ở pH khoảng 2,8. Do đó trong điều kiện xử lý nước thường gặp (pH 5-9) quá trình xảy ra không hiệu quả. Đã có nhiều nghiên cứu về các dạng cải tiến của phương pháp Fenton để tránh được pH thấp như quá trình photon-Fenton, Fenton điện hóa …
Ngoài ra còn phát sinh một vấn đề là cần tách ion sắt sau xử lý. Những nghiên cứu về quá trình Fenton dị thể xảy ra trên xúc tác rắn như Goethite đã giải quyết được vấn đề này đồng thời có thể tiến hành quá trình Fenton ngay ở pH trung tính.

1. Quá trình Fenton đồng thể
Thông thường qui trình oxi hóa Fenton đồng thể gồm 4 giai đoạn:
• Điều chỉnh pH phù hợp
• Phản ứng oxi hóa
Trong giai đoạn phản ứng oxi hóa xảy ra sự hình thành gốc •OH hoạt tính và phản ứng oxi hóa chất hữu cơ. Cơ chế hình thành gốc •OH sẽ được xét cụ thể sau. Gốc •OH sau khi hình thành sẽ tham gia vào phản ứng ôxi hóa các hợp chất hữu cơ có trong nước cần xử lý: chuyển chất hữu cơ từ dạng cao phân thành các chất hữu cơ có khối lượng phân tử thấp CHC (cao phân tử) +•HO CHC (thấp phân tử) +CO2 +H2O+ OH-
• Trung hòa và keo tụ
Sau khi xảy ra quá trình oxi hóa cần nâng pH dung dịch lên >7 để thực hiện kết tủa Fe3+ mới hình thành: Fe3+ + 3OH- Fe(OH)3 Kết tủa Fe(OH)3 mới hình thành sẽ thực hiện các cơ chế keo tụ, đông tụ, hấp phụ một phần các chất hữu cơ chủ yếu là các chất hữu cơ cao phân tử.
• Quá trình lắng:
Các bông keo sau khi hình thành sẽ lắng xuống khiến làm giảm COD, mầu, mùi trong nước thải. Sau quá trình lắng các chất hữu cơ còn lại (nếu có) trong nước thải chủ yếu là các hợp chất hữu cơ có khối lượng phân tử thấp sẽ được xử lý bổ sung bằng phương pháp sinh học hoặc bằng các phương pháp khác.
Cơ chế tạo thành gốc hydroxyl •OH và động học các phản ứng Fenton:
* Phản ứng giữa H2O2 và chất xúc tác Fe+2
Mặc dù tác nhân Fenton đã được biết hàng thế kỷ nay nhưng cơ chế của phản ứng Fenton cho đến nay vẫn còn đang tranh cãi, thậm chí có ý kiến trái ngược nhau. Hệ tác nhân Fenton cổ điển là một hỗn hợp gồm các ion sắt hóa trị 2 (thông thường dùng muối FeSO4) và hydro peroxit H2O2, chúng tác dụng với nhau sinh ra gốc tự do •OH, còn Fe2+¬ bị oxi hóa thành Fe3+¬ theo phản ứng:
Fe2+ + H2O2 –> Fe3+ + •OH + OH ¬
– Phản ứng trên được gọi là phản ứng Fenton do ông là người đầu tiên đã mô tả quá trình này. Phản ứng Fenton đã tiếp tục được nghiên cứu bởi nhiều tác giả sau này, các nghiên cứu này cho thấy ngoài phản ứng trên là phản ứng chính thì trong quá trình Fenton còn có xảy ra các phản ứng khác.
Tổng hợp lại bao gồm:
Fe2+ + H2O2 –> Fe3+ + •OH + OH- (1)
Fe3+ + H2O2 –> Fe2+ + •HO2 + H+ (2)
•OH + Fe2+ –> OH ¬- + Fe3+ (3)
•OH + H2O2 –> H2O + •HO2 (4)
Fe2+ + •HO2 –> Fe3+ + HO2 – (5)
Fe3+ + •HO2 –> Fe2+ +O2 + H+ (6)
Những phản ứng trên chứng tỏ tác dụng của sắt đóng vai trò là chất xúc tác. Quá trình chuyển Fe3+ thành Fe2+ như mô tả trong phản ứng (2) xảy ra rất chậm, hằng số tốc độ k rất nhỏ so với phản ứng (1) vì vậy sắt tồn tại sau phản ứng chủ yếu ở dạng Fe3+.
Theo Walling, C. (1975) gốc tự do •OH sinh ra có khả năng phản ứng với Fe2+ và H2O2 nhưng quan trọng nhất là khả năng phản ứng với nhiều chất hữu cơ (RH) tạo thành các gốc hữu cơ có khả năng phản ứng cao, từ đó sẽ phát triển tiếp tục theo kiểu dây chuỗi:
•OH + Fe2+ —> OH ¬- + Fe3+
•OH + H2O2 –> H2O + •HO2
•OH + RH –> •R + H2O
Các gốc •R có thể oxy hóa Fe2+ , khử Fe3+ hoặc dimer hóa .
Tuy nhiên như đã nói ở trên cơ chế phản ứng Fenton, đặc biệt là sự tạo thành các hợp chất trung gian cũng như sự hình thành gốc hydroxyl vẫn còn nhiều tranh cãi. Kremer (1999) cho rằng các sản phẩm trung gian có thể là phức chất Fe2+.H2O2 hydrat hóa và ion FeO2+ vì thuận lợi hơn về mặt nhiệt động và tác nhân ôxi hóa khử là FeO2+ chứ không phải gốc hydroxyl, mặt khác ông cũng cho rằng chất trung gian Fe2+.H2O2 có thể tham gia trực tiếp vào quá trình oxi hóa. Tuy nhiên tuyệt đại đa số đều nhất trí cao với cớ chế phản ứng Fenton xảy ra theo các phản ứng (1)-(6) đã nêu trên và thừa nhận vai trò của gốc hydroxyl tạo ra trong phản ứng Fenton.
* Phản ứng giữa H2O2 và chất xúc tác Fe3+:
Phản ứng (2) xảy ra xem như phản ứng phân hủy H2O2 bằng chất xúc tác Fe3+ và tạo ra Fe2+ để sau đó tiếp tục xảy ra theo phản ứng (1) hình thành gốc hydroxyl theo phản ứng Fenton. Tuy nhiên tốc độ ban đầu của phản ứng ôxy hóa bằng tác nhân H2O2 / Fe3+ chậm hơn rất nhiều so với tác nhân Fenton H2O2 / Fe2+. Nguyên nhân vì trong trường hợp này Fe3+ phải được khử thành Fe2+ trước khi hình thành gốc hydroxyl. Như vậy về tổng thể quá trình Fenton được xem như không phụ thuộc gì vào trạng thái hóa trị hai hay ba của các ion sắt.
2. Quá trình Fenton dị thể:
Nhược điểm quan trọng nhất của quá trình Fenton đồng thể là phải thực hiện ở pH thấp, sau khi xử lý phải nâng pH lên > 7 để tách các ion Fe3+ ra khỏi nước thải sau xử lý bằng nước vôi hoặc dung dịch kiềm nhằm chuyển sang dạng keo Fe(OH)3 kết tủa, sau đó phải qua thiết bị lắng hoặc lọc ép để tách bã keo Fe(OH)3, tạo ra một lượng bùn kết tủa chứa rất nhiều sắt. Vì vậy để khắc phục nhược điểm trên nguồn sắt được sử dụng làm xúc tác đã có nhiều công trình nghiên cứu thay thế bằng quặng sắt Goethite (-FeOOH), cát có chứa sắt, hoặc sắt trên chất mang Fe/SiO2, Fe/TiO2, Fe/than hoạt tính, Fe/Zeolit… quá trình này xảy ra cũng giống như quá trình Fenton đã khảo sát ở trên nên gọi là quá trình kiểu Fenton hệ dị thể.
Fenton dị thể được phát hiện đầu tiên bởi Ravikumar et al.(1994) cho thấy H2O2 có thể ôxi hóa các chât ô nhiễm hữu cơ như pentaclorophenol và tricloroetylene khi có mặt cát có chứa sắt tự nhiên. Tiếp theo đã có một số nghiên cứu sử dụng hỗn hợp H2O2 và quặng sắt loại goethite (alpha-FeOOH) làm tác nhân ôxi hóa để xử lý nước thải chứa các chất hữu cơ độc hại. Nước thải sau khi ra khỏi thiết bị phản ứng không cần xử lý tách kết tủa Fe(OH)3 vì sắt nằm trong thành phần quặng goethite dị thể. Người ta cũng đã thử nghiệm thêm với các oxit sắt ba như grama-FeOOH, hematite (alpha-Fe2O3), magnetite (Fe3O4) …tuy nhiên tốt nhất trong số này chỉ có Goethite. Goethite là một khoáng sản có sẵn trong thiên nhiên, hoặc cũng có thể thu được bằng tổng hợp từ feric nitrat và kali hydroxit ở nhiệt độ cao.
Dạng ion sắt trên chất mang cũng được thử nghiệm cho thấy kết quả làm mất mầu thuốc nhuộm rất hiệu quả khi sử dụng hệ H2O2 có mặt xúc tác Fe/MgO.
Cơ chế quá trình dị thể kiểu như Fenton xảy ra phản ứng với H2O2 trên quặng sắt loại goethite (alpha-FeOOH) xảy ra theo 2 khả năng :
Phản ứng Fenton được khởi đầu bằng việc sinh ra Fe(II) nhờ sự có mặt của H2O2 xảy ra hiện tượng khử – hòa tan goethite . sau đó xảy ra sự tái kết tủa Fe(III) trở về goethite. Quá trình này có thể được biểu diễn theo các bước sau:
anpha-FeOOH(s) + 2H+ + ½ H2O2 –> FeII + 1/2O2 +2H2O
FeII + H2O2 —> Fe(III) + •HO +OH-
Fe(III) + H2O+OH- –> alpha-FeOOH(s) + 2H+
Đây là một cách tiếp cận tương đối đơn giản vì thực chất quá trình như quá trình Fenton đồng thể với khởi đẩu là xảy ra sự khử và hòa tan Fe(II) vào dung dịch.
* Một số ưu điểm đáng chú ý của quá trình Fenton dị thể trên Goethite:
– Chất xúc tác này có thể sử dụng trong một thời gian dài mà không cần phải hoàn nguyên hoặc thay thế, đồng thời có thể tách ra dễ dàng khỏi khối phản ứng. Trong quá trình Fenton đồng thể, ion sắt hòa tan không thể tách ra khỏi khối phản ứng một cách đơn giản bằng quá trình lắng lọc, chỉ có cách dùng kiềm để keo tụ và kết tủa, sau đó lắng và lọc, sinh ra một khối lượng lớn bùn keo tụ chứa nhiều sắt.
– Tốc độ hình thành gốc hydroxyl tăng theo độ tăng pH trong khoảng từ 5-9, trong khi đó Fenton đồng thể tốc độ giảm mạnh khi pH tăng.
– Hiệu quả oxi hóa xúc tác của goethithe không bị ảnh hưởng đáng kể bởi nông độ cacbonat vô cơ.
II. Các quá trình Fenton cải tiến:
1.Quá trình Fenton điện hóa:
Quá trình Fenton điện hóa (E.Fenton) là quá trình Fenton sử dụng các tác nhân phản ứng sinh ra trong quá trình điện hóa.
• H2O2 được tạo ra trong quá trình điện hóa theo cơ chế sau: Ở anốt xảy ra sự oxi hóa nước tạo ra oxi phân tử theo phương trình :
2H2O -4e –> O2 + 4H+
Chính oxi phân tử này lại bị khử ở catốt để tạo thành H2O2 theo phương trình:
O2 + 2H+ +2e -> H2O2
• Ion Fe2+ có thể bổ sung vào hệ hoặc có thể tự tạo ra khi điện phân nếu sử dụng điện cực anốt hòa tan điện hóa (anốt hoạt động) là sắt, khi nhường điện tử, sắt sẽ hòa tan tạo ra các ion Fe2+ vào dung dịch, làm điện cực hy sinh trong quá trình điện phân. Đặc điểm quan trọng của qúa trình Fenton điện hóa chính là ở chỗ khi phản ứng Fenton xảy ra giữa Fe2+ và H2O2 theo phương trình (1) sẽ tạo ra Fe3+, chính Fe3+ này tiếp tục bị khử thành Fe2+ trực tiếp trên catot theo phương trình sau:
Fe3++e —> Fe2+
Do đó quá trình Fenton được liên tục tiếp diễn nhờ các quá trình điện cực xảy ra như đã mô tả trên.
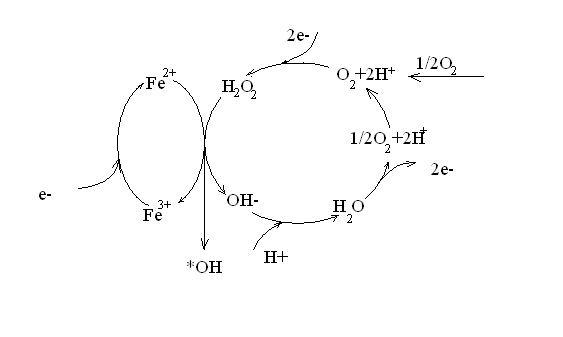
Hình: quá trình Fenton điện hóa
Hình trên cho thấy quá trình Fenton điện hóa bao gồm 2 chu trình : chu trình oxi hóa – khử các ion sắt và chu trình oxi hóa nước và khử oxi trên các điện cực. Trong quá trình Fenton điện hóa tùy theo cách đưa nguồn ion Fe2+ vào hệ còn phân biệt 2 quá trình: quá trình Fenton Catốt và quá trình Fenton Anốt.
– Quá trình Fenton anốt:
Trong quá trình này, nguồn ion Fe2+ không phải đưa vào hệ, điện cực sắt được sử dụng làm anốt và là nguồn cung cấp Fe2+, vì vậy cực anốt bị mòn dần và trở thành điện cực hy sinh trong quá trình điện hóa. Điện cực graphít dùng làm catốt để thực hiện quá trình khử oxi thành H2O2. Vì vậy trong quá trình này, tác nhân Fenton (Fe2+ /H2O2) được sinh ra bằng con đường điện hóa ở trên điện cực anốt và catốt. Trong quá trình Fenton anốt thiết bị phản ứng điện hóa gồm 2 ngăn riêng biệt, giữa 2 ngăn nối bằng cầu nối là muối điện ly.
Quá trình Fenton anốt ưu việt hơn Fenton cổ điển vì :
• Quá trình Fenton anốt thực hiện trong điều kiện trung tính. Độ pH của nước xử lý khi đi ra cũng có thể được trung hòa bằng cách kết hợp các dung dịch anốt và catốt ở 2 ngăn của thùng điện phân.
• Không cần thêm Fe2+ vào hệ xử lý vì chúng được sinh ra liên tục nhờ sử dụng điện cực hy sinh là sắt. Điều này có ý nghĩa thực tế rất quan trọng vì nếu sử dụng muối Fe2+ như quá trình Fenton cổ điển sẽ gặp nhiều vấn do chúng rất dễ hút nước và dễ bị oxi hóa khi bảo quản, hoặc nếu dùng muối Fe3+ chúng có tính ăn mòn và oxi hóa rất mạnh.
– Quá trình Fenton catốt:
Trong qúa trình này Fe2+ được đưa vào hệ từ đầu và H2O2 được sinh ra ngay trong hệ. Tuy nhiên về sau không cần bổ sung Fe2+ vì Fe3+ sinh ra trong phản ứng Fenton sẽ được khử ngay trên catốt trong quá trình điện phân. Sự khử Fe3+ để tạo ra Fe2+ và sự khử O2 để tạo H2O2 xảy ra đồng thời ở catốt với tốc độ gần như nhau. Trong quá trình Fenton catốt thiết bị phản ứng điện hóa là một khối không có vách ngăn cách. Điện cực anốt được chế tạo bằng các vật liệu trơ như platin, titan phủ màng mỏng platin, trong khi đó điện cực làm catốt là vật liện chứa cacbon.
Vì Fe2+ và H2O2 liên tục được sinh ra trong quá trình điện hóa với một tốc độ kiểm soát được nên so với quá trình Fenton cổ điển Fenton catốt hiệu quả cao hơn, mức độ phân hủy các chất hữu cơ cũng hoàn toàn hơn.
Những công trình nghiên cứu gần đây cho thấy cơ chế quá trình oxi hóa điện hóa phụ thuộc vào đặc tính điện hóa hoặc đặc tính hóa học của điện cực anốt sử dụng. Theo Rodgers et al.(1999) nếu sử dụng dioxit chì, quá trình oxi hóa xảy ra bằng cách chuyển e trực tiếp vào điện cực, không thông qua gốc •OH trong khi đó quá trình oxi hóa xảy ra gián tiếp thông qua gốc hydroxyl khi sử dụng anốt là dioxít thiếc hoặc đioxit iridi.
2. Quá trình quang Fenton:
Theo phản ứng (2): Fe3+ sau khi được tạo ra sẽ tiếp tục phản ứng với H2O2 tạo thành Fe2+, lại tiếp tục tham gia phản ứng (1). Tuy nhiên vì hằng số tốc độ của phản ứng (2) rất thấp (k=3,1*10-3 M-1s-1) so với phản ứng (1), k=63 M-1s-1 nên quá trình phân hủy H2O2 chủ yếu do phản ứng (1) thực hiện. vì thế trong thực tế phản ứng xảy ra với tốc độ chậm dần lại sau khi toàn bộ Fe2+ đã sử dụng hết cho phản ứng (1) và chuyển thành Fe3+.
Các nghiên cứu gần đây cho thấy phản ứng (1) thậm chí cả phản ứng (2) nếu đặt dưới bức xạ của ánh sáng UV hoặc lân cận UV và ánh sáng khả kiến đều được nâng cao rõ rệt và nhờ đó có thể khoáng hóa dễ dàng các chất ô nhiễm hữu cơ, ngay cả những chất hữu cơ khó phân hủy như các loại thuốc trừ sâu, diệt cỏ dại. Quá trình này được gọi là quá trình quang Fenton, thực chất là quá trình Fenton được nâng cao nhờ bức xạ của các photon ánh sáng.
– Bản chất quá trình quang Fenton:
Trong những điều kiện tối ưu của quá trình Fenton tức khi pH thấp (pH<4), ion Fe3+ phần lớn nằm dưới dạng phức [Fe3+ (OH)-]2+. Chính dạng này hấp thu ánh sáng UV trong miền 250< gamma<400 nm rất mạnh, hơn hẳn so với ion Fe3+. Phản ứng khử [Fe3+ (OH)-]2+ trong dung dịch bằng quá trình quang hóa học cho phép tạo ra một số gốc •HO phụ thêm theo phương trình sau:
Fe3+ + H2O –> [Fe3+ (OH)-]2+ + H+
[Fe3+ (OH)-]2+ + hv —> Fe2+ + •HO
Tổng hợp 2 phương trình trên sẽ được:
Fe3+ + H2O + hv –> Fe2+ + H+ + •HO (7)
Phản ứng này là phản ứng đặc trưng của quá trình quang Fenton. Tiếp theo sau phản ứng trên sẽ là phản ứng Fenton thông thường. Do đó nhờ tác dụng bức xạ của UV, ion sắt được chuyển hóa trạng thái Fe3+ sang Fe2+ và sau đó ngược lại Fe2+ sang Fe3+ bằng quá trình Fenton thông thường tạo thành một chu kỳ không dừng, đây chính là điểm khác biệt giữa quá trình Fenton thông thường và quang Fenton.
So với quá trình Fenton thông thường, quá trình quang Fenton xảy ra tạo gốc •HO được phát triển rất thuận lợi. nếu tổ hợp 2 phương trình (1) và (7) sẽ được 2 gốc •HO tạo thành từ một phân tử H2O2. Đó chính là lợi thế ưu việt của quá trình quang Fenton. Tốc độ khử quang hóa Fe3+ tạo ra gốc •HO và Fe2+ phụ thuộc vào chiều dài của bước sóng ánh sáng bức xạ. Bước sóng càng dài hiệu suất lượng tử tạo gốc •HO càng giảm.
3. Fenton- HA:[2]
Những quá trình oxy hoá liên quan đến việc sản xuất gốc hydroxyl nói chung và quá trình Fenton nói riêng cho hiệu quả rất cao trong việc phân huỷ các hợp chất hữu cơ trong nước bề mặt, nước ngầm hay nước thải công nghiệp. Tuy nhiên pH tối ưu của quá trình này thường trong vùng axit khoảng pH 3 nên làm hạn chế khả năng ứng dụng của nó trong công nghệ môi trường. Nguyên nhân chính là do sự kết tủa của Fe(III) ở pH cao làm hạn chế quá trình tuần hoàn Fe(III)/Fe(II). Để giữ Fe ở trạng thái hoà tan, các nhà khoa học đã và đang nghiên cứu sử dụng các chelat nhân tạo nhằm mục đích mở rộng khoảng pH tối ưu của quá trình lên vùng pH trung tính. Hợp chất humic là một trong các tác nhân được sử dụng nhiều trong các hệ thống Fenton cải tiến (Fenton-HA) hiện nay.
Hợp chất humic thường gặp trong tự nhiên có phân tử lượng lớn do kết quả của sự biến đổi sinh học và hoá học của các vụn hữu cơ. Hợp chất humic được phân loại là axit humic (HA), axit fulvic (FA) cũng như humin theo tính tan của chúng. Axit humic có thể được sử dụng với chi phí tương đối thấp nhờ sự điều chế kiềm từ than bùn hay than non, vì vậy nó rất sẵn có ở khắp mọi nơi. Bên cạnh chức năng là chelat sắt, tác dụng khác của các hợp chất humic trong hệ thống Fenton là khả năng là một chất hấp phụ các hợp chất hữu cơ hydrophobic và là một chất khử.
Theo các nhà khoa học phản ứng ban đầu trong hệ thống là của Fe(III) và H2O2 với nồng độ ban đầu của Fe(III) nhỏ hơn rất nhiều so với nồng độ của H2O2. Bởi vậy, sự biến đổi của Fe(III) đã được cho rằng chính là yếu tố giới hạn của bước phản ứng tạo ra OH* trong toàn bộ quá trình. Trong hệ thống Fenton không có HA, tốc độ của phản ứng đã giảm một cách đáng kể khi tăng dần pH, giá trị pH tối ưu của quá trình Fenton oxy hoá các hợp chất hữu cơ phần lớn chúng nằm trong khoảng pH 2.5 – 3.5, khi dung dịch có pH 5-7 sẽ xuất hiện sự kết tủa của Fe (III) dưới dạng Fe2O3.nH2O tuy nhiên điều này không còn xảy ra ở các dung dịch có 30 microM Fe(III) và chứa HA nồng độ khoảng 10-100 mg/l.
Hiệu quả xử lý của hệ thống Fenton cải tiến trong môi trường trung tính đã được nghiên cứu với nhiều chất ô nhiễm khác nhau cho kết quả tương tự nhau và khá khả quan so với hệ thống Fenton thông thường. Tại pH 3 tốc độ của phản ứng chịu ảnh hưởng không đáng kể với sự có mặt của HA. Phản ứng phân huỷ benzene tiến hành trong dung dịch không HA và có HA ở pH 3 có hằng số tốc độ khác nhau không đáng kể, trường hợp không HA là K= (9.0 ± 0.9).10-3 min-1 và trong trường hợp có HA K = (12±2.0)10-3min-1. Kết quả này phù hợp với những tác động chậm do thêm HA và FA trong quá trình phân huỷ trinitrotoluen trong hệ thống Fenton ở pH 3 đã được công bố năm 1998. Tuy nhiên, quá trình phân huỷ các chất ô nhiễm ở pH 5- 7 được tăng tốc đáng kể nhờ sự có mặt của HA, đó là do HA đã tạo các phức hòa tan với sắt, các phức này có khả năng hoạt hoá H2O2. Hiệu quả phân huỷ benzene sau thời gian phản ứng là 5 giờ tại pH 5 của hệ thống Fenton thường chỉ khoảng 35%, còn hệ thống Fenton-HA là 95%, còn tại pH 6 hệ thống Fenton thường là 30% trong khi đó của hệ thống Fenton cải tiến là 70%.
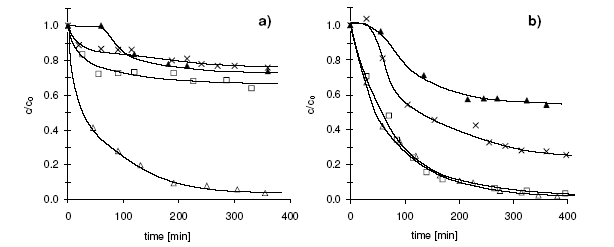
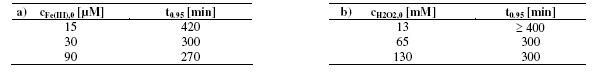
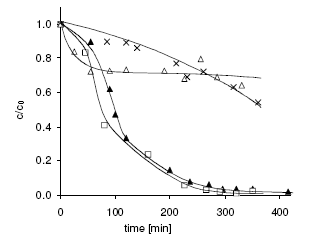
Tác động của nồng độ HA lên tốc độ phân huỷ benzen được thể hiện trong đồ thị. Tại nồng độ HA 10 mg/l, sau một giai đoạn chậm, phản ứng trở nên nhanh hơn mà không cần thêm HA. Nồng độ HA 10 mg/l đủ để giữ cho sắt tồn tại trong dung dịch. Mặt khác, tác động tích cực của HA lên phản ứng oxy hoá cũng tăng khi tăng nồng độ HA. Nếu cho HA là 50 hoặc 100 mg/1, giai đoạn phản ứng chậm sẽ ngắn lại và 95% benzen bị phân huỷ sau thời gian phản ứng là 5h so với 35% trong dung dịch không có HA. Có kết quả này là vì nhờ sự có mặt cả HA nên Fe(III) không bị kết tủa, không gây ảnh hưởng đến chu trình tuần hoàn Fe(III)/Fe(II).
Nguồn: Sưu tầm
